Пока мы живем, в нашем организме, незаметно для нас самих, протекают важнейшие процессы. Деление, самообновление и замена состарившихся клеток новыми – один из самых важных. Благодаря регенерации клеток организма мы растем, взрослеем, заживляем раны, и просто живем. Стоит замедлиться процессам регенерации, как неизменно наступает старость, а при полном их прекращении нас ждет быстрая смерть.
Типы регенерации
Наш организм может запускать два вида регенерации: на каждый день и на экстренный случай. Ежедневная регенерация является физиологической и никогда не останавливается. Так, мы обновляем клетки кожи, слизистых оболочек, крови, костного мозга и даже роговицы. Примером такой регенерации является постоянный рост ногтей и волос, он никогда не останавливается, пока человек жив. Но обновления в нашем теле идут с разной скоростью. Они могут занимать всего пару суток — от старой ткани до полностью новой, в кишечнике, или до месяца – для полного обновления кожи. В тканях печени и почек процесс регенерации идет куда медленнее, а деления клеток нервных тканей вообще не существует. Потому и говорят, что нервные клетки не восстанавливаются.
Репаративная регенерация – тот самый спасательный круг на экстренный случай. Таким образом, тело восстанавливается после ранений. Процесс проходит одинаково — для небольшой ранки на пальце и для повреждений кожи после серьезной операции. При помощи такого же процесса у ящерицы отрастает новый хвост.
Запуск регенерации
Физиологическая регенерация имеет две фазы, это образование новых клеток и разрушение старых. Причем разрушение идет первым, и порой осуществляется активнее, чем восстановление. Ученые давно выяснили, что именно процессы распада клеток стимулируют организм производить другие клетки им на замену. Особую роль, в запуске процессов восстановления клеток и производства новых, имеют гормоны и пептиды. Они обеспечивают передачу информации от одной клетки и системы к другой, так клетки — восстановители узнают, какое количество и каких клеток нужно произвести. Со временем количество пептидов сокращается, и они не всегда способны передать нужные данные, так что процесс регенерации идет куда медленнее.
Что влияет на регенерацию?
Чтобы регенерация осуществлялась, недостаточно одних пептидов. Клетки не могут строиться, если отсутствует строительный материал. Поэтому обязательно должны поступать питательные вещества из воды, воздуха и, конечно, пищи. Самым важным строительным материалом является аминокислота, которая вырабатывает пептид и белок, потому пища должна содержать достаточное количество белков и пептидов для нормализации процесса восстановления клеток. Липиды, кислоты, мононуклеины, микроэлементы, полисахариды – вот неполный список необходимых веществ для восстановления сложнейших систем человеческого организма.

Регенерация также может замедляться. Приостанавливает регенерацию, как мы уже упоминали, недостаточное количество пептидов, но, кроме них, влияние оказывает неправильное питание, загрязненная окружающая среда, нарушение циркуляции крови и стресс. На репаративную регенерацию серьезное воздействие оказывает воспалительный процесс в тканях.
Чтобы поддерживать на нужном уровне регенерацию клеток, ученые рекомендуют применять пептиды, иммуномодуляторы, а также витамины и минеральные комплексы, нейтрализующие воздействие неправильного питания. С рекомендуемыми многими врачами, гормональными и стероидными комплексами, мы бы советовали быть осторожнее – воздействие гормонов не до конца изучено, поэтому даже медики не могут в полной мере отвечать за возможные негативные последствия. Пептидные комплексы, для стимуляции регенерации в сочетании с полноценным отдыхом и правильным питанием, способны дать наилучший результат.
Общие сведения
Регенерация (от лат. regeneratio - возрождение) - восстановление (возмещение) структурных элементов ткани взамен погибших. В биологическом смысле регенерация представляет собой приспособительный процесс, выработанный в ходе эволюции и присущий всему живому. В жизнедеятельности организма каждое функциональное отправление требует затрат материального субстрата и его восстановления. Следовательно, при регенерации происходит самовоспроизведение живой материи, причем это самовоспроизведение живого отражает принцип ауторегуляции и автоматизации жизненных отправлений (Давыдовский И.В., 1969).
Регенераторное восстановление структуры может происходить на разных уровнях - молекулярном, субклеточном, клеточном, тканевом и органном, однако всегда речь идет о возмещении структуры, которая способна выполнять специализированную функцию. Регенерация - это восстановление как структуры, так и функции. Значение регенераторного процесса - в материальном обеспечении гомеостаза.
Восстановление структуры и функции может осуществляться с помощью клеточных или внутриклеточных гиперпластических процессов. На этом основании различают клеточную и внутриклеточную формы регенерации (Саркисов Д.С., 1977). Для клеточной формы регенерации характерно размножение клеток митотическим и амитотическим путем, для внутриклеточной формы, которая может быть органоидной и внутриорганоидной, - увеличение числа (гиперплазия) и размеров (гипертрофия) ультраструктур (ядра, ядрышек, митохондрий, рибосом, пластинчатого комплекса и т.д.) и их компонентов (см. рис. 5, 11, 15). Внутриклеточная форма регенерации является универсальной, так как она свойственна всем органам и тканям. Однако структурно-функциональная специализация органов и тканей в фило- и онтогенезе «отобрала» для одних преимущественно клеточнуую форму, для других - преимущественно или исключительно внутриклеточную, для третьих - в равной мере обе формы регенерации (табл. 5). Преобладание той или иной формы регенерации в определенных органах и тканях определяется их функциональным назначением, структурно-функциональной специализацией. Необходимость сохранения целостности покровов тела объясняет, например, преобладание клеточной формы регенерации эпителия как кожи, так и слизистых оболочек. Специализированная функция пирамидной клетки головного
мозга, как и мышечной клетки сердца, исключает возможность деления этих клеток и позволяет понять необходимость отбора в фило- и онтогенезе внутриклеточной регенерации как единственной формы восстановления данного субстрата.
Таблица 5. Формы регенерации в органах и тканях млекопитающих (по Саркисову Д.С., 1988)
Эти данные опровергают существовавшие до недавнего времени представления об утрате некоторыми органами и тканями млекопитающих способности к регенерации, о «плохо» и «хорошо» регенерирующих тканях человека, о том, что существует «закон обратной зависимости» между степенью дифференцировки тканей и способностью их к регенерации. В настоящее время установлено, что в ходе эволюции способность к регенерации в некоторых тканях и органах не исчезла, а приняла формы (клеточную или внутриклеточную), соответствующие их структурному и функциональному своеобразию (Саркисов Д.С., 1977). Таким образом, все ткани и органы обладают способностью к регенерации, различны лишь ее формы в зависимости от структурно-функциональной специализации ткани или органа.
Морфогенез регенераторного процесса складывается из двух фаз - пролиферации и дифференцировки. Особенно хорошо эти фазы выражены при клеточной форме регенерации. В фазу пролиферации размножаются молодые, недифференцированные клетки. Эти клетки называют камбиальными (от лат. cambium - обмен, смена), стволовыми клетками и клетками-предшественниками.
Для каждой ткани характерны свои камбиальные клетки, которые отличаются степенью пролиферативной активности и специализации, однако одна стволовая клетка может быть родоначальником нескольких видов
клеток (например, стволовая клетка кроветворной системы, лимфоидной ткани, некоторые клеточные представители соединительной ткани).
В фазу дифференцировки молодые клетки созревают, происходит их структурно-функциональная специализация. Та же смена гиперплазии ультраструктур их дифференцировкой (созреванием) лежит в основе механизма внутриклеточной регенерации.
Регуляция регенераторного процесса. Среди регуляторных механизмов регенерации различают гуморальные, иммунологические, нервные, функциональные.
Гуморальные механизмы реализуются как в клетках поврежденных органов и тканей (внутритканевые и внутриклеточные регуляторы), так и за их пределами (гормоны, поэтины, медиаторы, факторы роста и др.). К гуморальным регуляторам относят кейлоны (от греч. chalaino - ослаблять) - вещества, способные подавлять деление клеток и синтез ДНК; они обладают тканевой специфичностью. Иммунологические механизмы регуляции связаны с «регенерационной информацией», переносимой лимфоцитами. В связи с этим следует заметить, что механизмы иммунологического гомеостаза определяют и структурный гомеостаз. Нервные механизмы регенераторных процессов связаны прежде всего с трофической функцией нервной системы, а функциональные механизмы - с функциональным «запросом» органа, ткани, который рассматривается как стимул к регенерации.
Развитие регенераторного процесса во многом зависит от ряда общих и местных условий, или факторов. К общим следует отнести возраст, конституцию, характер питания, состояние обмена и кроветворения, к местным - состояние иннервации, крово- и лимфообращения ткани, пролиферативную активность ее клеток, характер патологического процесса.
Классификация. Различают три вида регенерации: физиологическую, репаративную и патологическую.
Физиологическая регенерация совершается в течение всей жизни и характеризуется постоянным обновлением клеток, волокнистых структур, основного вещества соединительной ткани. Нет таких структур, которые не подвергались бы физиологической регенерации. Там, где доминирует клеточная форма регенерации, имеет место обновление клеток. Так происходит постоянная смена покровного эпителия кожи и слизистых оболочек, секреторного эпителия экзокринных желез, клеток, выстилающих серозные и синовиальные оболочки, клеточных элементов соединительной ткани, эритроцитов, лейкоцитов и тромбоцитов крови и т.д. В тканях и органах, где клеточная форма регенерации утрачена, например в сердце, головном мозге, происходит обновление внутриклеточных структур. Наряду с обновлением клеток и субклеточных структур постоянно совершается биохимическая регенерация, т.е. обновление молекулярного состава всех компонентов тела.
Репаративная или восстановительная регенерация наблюдается при различных патологических процессах, ведущих к повреждению клеток и тка-
ней. Механизмы репаративной и физиологической регенерации едины, репаративная регенерация - это усиленная физиологическая регенерация. Однако в связи с тем, что репаративная регенерация побуждается патологическими процессами, она имеет качественные морфологические отличия от физиологической. Репаративная регенерация может быть полной и неполной.
Полная регенерация, или реституция, характеризуется возмещением дефекта тканью, которая идентична погибшей. Она развивается преимущественно в тканях, где преобладает клеточная регенерация. Так, в соединительной ткани, костях, коже и слизистых оболочках даже относительно крупные дефекты органа могут путем деления клеток замещаться тканью, идентичной погибшей. При неполной регенерации, или субституции, дефект замещается соединительной тканью, рубцом. Субституция характерна для органов и тканей, в которых преобладает внутриклеточная форма регенерации, либо она сочетается с клеточной регенерацией. Поскольку при регенерации происходит восстановление структуры, способной к выполнению специализированной функции, смысл неполной регенерации не в замещении дефекта рубцом, а в компенсаторной гиперплазии элементов оставшейся специализированной ткани, масса которой увеличивается, т.е. происходит гипертрофия ткани.
При неполной регенерации, т.е. заживлении ткани рубцом, возникает гипертрофия как выражение регенераторного процесса, поэтому ее называют регенерационной, в ней - биологический смысл репаративной регенерации. Регенераторная гипертрофия может осуществляться двумя путями - с помощью гиперплазии клеток или гиперплазии и гипертрофии клеточных ультраструктур, т.е. гипертрофии клеток.
Восстановление исходной массы органа и его функции за счет преимущественно гиперплазии клеток происходит при регенерационной гипертрофии печени, почек, поджелудочной железы, надпочечников, легких, селезенки и др. Регенерационная гипертрофия за счет гиперплазии клеточных ультраструктур характерна для миокарда, головного мозга, т.е. тех органов, где преобладает внутриклеточная форма регенерации. В миокарде, например, по периферии рубца, заместившего инфаркт, размеры мышечных волокон значительно увеличиваются, т.е. они гипертрофируются в связи с гиперплазией их субклеточных элементов (рис. 81). Оба пути регенерационной гипертрофии не исключают друг друга, а, наоборот, нередко сочетаются. Так, при регенерационной гипертрофии печени происходит не только увеличение числа клеток в сохранившейся после повреждения части органа, но и гипертрофия их, обусловленная гиперплазией ультраструктур. Нельзя исключить того, что в мышце сердца регенерационная гипертрофия может протекать не только в виде гипертрофии волокон, но и путем увеличения числа составляющих их мышечных клеток.
Восстановительный период обычно не ограничивается только тем, что в поврежденном органе развертывается репаративная регенерация. Если
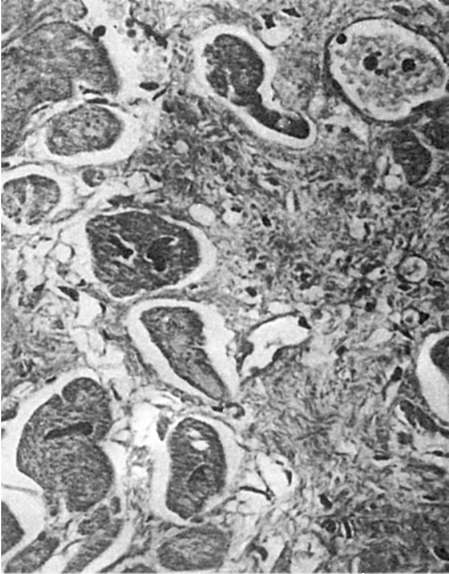 Рис. 81.
Регенерационная гипертрофия миокарда. По периферии рубца расположены гипертрофированные мышечные волокна
Рис. 81.
Регенерационная гипертрофия миокарда. По периферии рубца расположены гипертрофированные мышечные волокна
воздействие патогенного фактора прекращается до гибели клетки, происходит постепенное восстановление поврежденных органелл. Следовательно, проявления репаративной реакции должны быть расширены за счет включения восстановительных внутриклеточных процессов в дистрофически измененных органах. Общепринятое мнение о регенерации только как о завершающем этапе патологического процесса малооправданно. Репаративная регенерация не местная, а общая реакция организма, охватывающая различные органы, но реализующаяся в полной мере лишь в том или ином из них.
О патологической регенерации говорят в тех случаях, когда в результате тех или иных причин имеется извращение регенераторного процесса, нарушение смены фаз пролиферации
и дифференцировки. Патологическая регенерация проявляется в избыточном или недостаточном образовании регенерирующей ткани (гипер- или гипорегенерация), а также в превращении в ходе регенерации одного вида ткани в другой [метаплазия - см. Процессы приспособления (адаптации) и компенсации]. Примерами могут служить гиперпродукция соединительной ткани с образованием келоида, избыточная регенерация периферических нервов и избыточное образование костной мозоли при срастании перелома, вялое заживление ран и метаплазия эпителия в очаге хронического воспаления. Патологическая регенерация обычно развивается при нарушениях общих и местных условий регенерации (нарушение иннервации, белковое и витаминное голодание, хроническое воспаление и т.д.).
Регенерация отдельных тканей и органов
Репаративная регенерация крови отличается от физиологической прежде всего своей большей интенсивностью. При этом активный красный костный мозг появляется в длинных трубчатых костях на месте жирового костного мозга (миелоидное превращение жирового костного мозга). Жировые клетки вытесняются растущими островками кроветворной ткани, которая заполняет костномозговой канал и выглядит сочной, темнокрасной. Кроме того, кроветворение начинает происходить вне костного мозга - внекостномозговое, или экстрамедуллярное, кроветворение. Оча-
ги экстрамедуллярного (гетеротопического) кроветворения в результате выселения из костного мозга стволовых клеток появляются во многих органах и тканях - селезенке, печени, лимфатических узлах, слизистых оболочках, жировой клетчатке и т.д.
Регенерация крови может быть резко угнетена (например, при лучевой болезни, апластической анемии, алейкии, агранулоцитозе) или извращена (например, при злокачественной анемии, полицитемии, лейкозе). В кровь при этом поступают незрелые, функционально неполноценные и быстро разрушающиеся форменные элементы. В таких случаях говорят о патологической регенерации крови.
Репаративные возможности органов кроветворной и иммунокомпетентной системы неоднозначны. Костный мозг обладает очень высокими пластическими свойствами и может восстанавливаться даже при значительных повреждениях. Лимфатические узлы хорошо регенерируют только в тех случаях, когда сохраняются связи приносящих и выносящих лимфатических сосудов с окружающей их соединительной тканью. Регенерация ткани селезенки при повреждении бывает, как правило, неполной, погибшая ткань замещается рубцом.
Регенерация кровеносных и лимфатических сосудов протекает неоднозначно в зависимости от их калибра.
Микрососуды обладают большей способностью регенерировать, чем крупные сосуды. Новообразование микрососудов может происходить путем почкования или аутогенно. При регенерации сосудов путем почкования (рис. 82) в их стенке появляются боковые выпячивания за счет усиленно делящихся эндотелиальных клеток (ангиобласты). Образуются тяжи из эндотелия, в которых возникают просветы и в них поступает кровь или лимфа из «материнского» сосуда. Другие элементы: сосудистой стенки образуются за счет дифференцировки эндотелия и окружающих сосуд соединительнотканных клеток, В сосудистую стенку врастают нервные волокна из предсуществующих нервов. Аутогенное новообразование сосудов состоит в том, что в соединительной ткани появляются очаги недифференцированных клеток. В этих очагах возникают щели, в которые открываются предсуществующие капилляры и изливается кровь. Молодые клетки соединительной ткани, дифференцируясь, образуют эндотелиальную выстилку и другие элементы стенки сосуда.
 Рис. 82.
Регенерация сосудов путем почкования
Рис. 82.
Регенерация сосудов путем почкования
Крупные сосуды не обладают достаточными пластическими свойствами. Поэтому при повреждении их стенки восстанавливаются лишь структуры внутренней оболочки, ее эндотелиальная выстилка; элементы средней и наружной оболочек обычно замещаются соединительной тканью, что ведет нередко к сужению или облитерации просвета сосуда.
Регенерация соединительной ткани начинается с пролиферации молодых мезенхимальных элементов и новообразования микрососудов. Образуется молодая, богатая клетками и тонкостенными сосудами соединительная ткань, которая имеет характерный вид. Это - сочная темнокрасная ткань с зернистой, как бы усыпанной крупными гранулами поверхностью, что явилось основанием назвать ее грануляционной тканью. Гранулы представляют собой выступающие над поверхностью петли новообразованных тонкостенных сосудов, которые составляют основу грануляционной ткани. Между сосудами много недифференцированных лимфоцитоподобных клеток соединительной ткани, лейкоцитов, плазматических клеток и лаброцитов (рис. 83). В дальнейшем происходит созревание грануляционной ткани, в основе которой лежит дифференцировка клеточных элементов, волокнистых структур, а также сосудов. Число гематогенных элементов уменьшается, а фибробластов - увеличивается. В связи с синтезом фибробластами коллагена в межклеточных пространствах образуются аргирофильные (см. рис. 83), а затем и коллагеновые волокна. Синтез фибробластами гликозаминогликанов служит образованию
основного вещества соединительной ткани. По мере созревания фибробластов количество коллагеновых волокон увеличивается, они группируются в пучки; одновременно уменьшается количество сосудов, они дифференцируются в артерии и вены. Созревание грануляционной ткани завершается образованием грубоволокнистой рубцовой ткани.
Новообразование соединительной ткани происходит не только при ее повреждении, но и при неполной регенерации других тканей, а также при организации (инкапсуляции), заживлении ран, продуктивном воспалении.
Созревание грануляционной ткани может иметь те или иные отклонения. Воспаление, развивающееся в грануляционной ткани, приводит к задержке ее созревания,
 Рис. 83.
Грануляционная
ткань. Между тонкостенными сосудами много недифференцированных клеток
соединительной ткани и аргирофильных волокон. Импрегнация серебром
Рис. 83.
Грануляционная
ткань. Между тонкостенными сосудами много недифференцированных клеток
соединительной ткани и аргирофильных волокон. Импрегнация серебром
а чрезмерная синтетическая активность фибробластов - к избыточному образованию коллагеновых волокон с последующим резко выраженным их гиалинозом. В таких случаях возникает рубцовая ткань в виде опухолевидного образования синюшно-красного цвета, которая возвышается над поверхностью кожи в виде келоида. Келоидные рубцы образуются после различных травматических поражений кожи, особенно после ожогов.
Регенерация жировой ткани происходит за счет новообразования соединительнотканных клеток, которые превращаются в жировые (адипозоциты) путем накопления в цитоплазме липидов. Жировые клетки складываются в дольки, между которыми располагаются соединительнотканные прослойки с сосудами и нервами. Регенерация жировой ткани может происходить также из ядросодержащих остатков цитоплазмы жировых клеток.
Регенерация костной ткани при переломе костей в значительной мере зависит от степени разрушения кости, правильной репозиции костных отломков, местных условий (состояние кровообращения, воспаление и т.д.). При неосложненном костном переломе, когда костные отломки неподвижны, может происходить первичное костное сращение (рис. 84). Оно начинается с врастания в область дефекта и гематомы между отломками кости молодых мезенхимальных элементов и сосудов. Возникает так называемая предварительная соединительнотканная мозоль, в которой сразу же начинается образование кости. Оно связано с активацией и пролиферацией остеобластов в зоне повреждения, но прежде всего в периостате и эндостате. В остеогенной фиброретикулярной ткани появляются малообызвествленные костные балочки, число которых нарастает.
Образуется предварительная костная мозоль. В дальнейшем она созревает и превращается в зрелую пластинчатую кость - так образуется
 Рис. 84.
Первичное костное сращение. Интермедиарная костная мозоль (показана стрелкой), спаивающая отломки кости (по Г.И. Лаврищевой)
Рис. 84.
Первичное костное сращение. Интермедиарная костная мозоль (показана стрелкой), спаивающая отломки кости (по Г.И. Лаврищевой)
окончательная костная мозоль, которая по своему строению отличается от костной ткани лишь беспорядочным расположением костных перекладин. После того как кость начинает выполнять свою функцию и появляется статическая нагрузка, вновь образованная ткань с помощью остеокластов и остеобластов подвергается перестройке, появляется костный мозг, восстанавливаются васкуляризация и иннервация. При нарушении местных условий регенерации кости (расстройство кровообращения), подвижности отломков, обширных диафизарных переломах происходит вторичное костное сращение (рис. 85). Для этого вида костного сращения характерно образование между костными отломками сначала хрящевой ткани, на основе которой строится костная ткань. Поэтому при вторичном костном сращении говорят о предварительной костно-хрящевой мозоли, которая со временем превращается в зрелую кость. Вторичное костное сращение по сравнению с первичным встречается значительно чаще и занимает больше времени.
При неблагоприятных условиях регенерация костной ткани может быть нарушена. Так, при инфицировании раны регенерация кости задерживается. Костные осколки, которые при нормальном течении регенераторного процесса выполняют функцию каркаса для новообразованной костной ткани, в условиях нагноения раны поддерживают воспаление, что тормозит регенерацию. Иногда первичная костно-хрящевая мозоль не дифференцируется в костную. В этих случаях концы сломанной кости остаются подвижными, образуется ложный сустав. Избыточная продукция костной ткани в ходе регенерации приводит к появлению костных выростов - экзостозов.
Регенерация хрящевой ткани в отличие от костной происходит обычно неполно. Лишь небольшие дефекты ее могут замещаться новообразованной тканью за счет камбиальных элементов надхрящницы - хондробластов. Эти клетки создают основное вещество хряща, затем превращаются в зрелые хрящевые клетки. Крупные дефекты хряща замещаются рубцовой тканью.
Регенерация мышечной ткани, ее возможности и формы различны в зависимости от вида этой ткани. Гладкие мьшщы, клетки которых обладают способностью к митозу и амитозу, при незначительных дефектах могут регенерировать достаточно полно. Значительные участки повреждения гладких мышц замещаются рубцом, при этом сохранившиеся мышечные волокна подвергаются гипертрофии. Новообразование гладких мышечных волокон может происходить путем превращения (метаплазии) элементов соединительной ткани. Так образуются пучки гладких мышечных волокон в плевральных спайках, в подвергающихся организации тромбах, в сосудах при их дифференцировке.
Поперечнополосатые мышцы регенерируют лишь при сохранении сарколеммы. Внутри трубок из сарколеммы осуществляется регенерация ее органелл, в результате чего появляются клетки, называемые миобластами. Они вытягиваются, число ядер в них увеличивается, в саркоплазме
 Рис. 85.
Вторичное костное сращение (по Г.И. Лаврищевой):
Рис. 85.
Вторичное костное сращение (по Г.И. Лаврищевой):
а - костно-хрящевая периостальная мозоль; участок костной ткани среди хрящевой (микроскопическая картина); б - периостальная костно-хрящевая мозоль (гистотопограмма через 2 мес после операции): 1 - костная часть; 2 - хрящевая часть; 3 - отломки кости; в - периостальная мозоль, спаивающая смещенные отломки кости
дифференцируются миофибриллы, и трубки сарколеммы превращаются в поперечнополосатые мышечные волокна. Регенерация скелетных мышц может быть связана и с клетками-сателлитами, которые располагаются под сарколеммой, т.е. внутри мышечного волокна, и являются камбиальными. В случае травмы клетки-сателлиты начинают усиленно делиться, затем подвергаются дифференцировке и обеспечивают восстановление мышечных волокон. Если при повреждении мышцы целость волокон нарушается, то на концах их разрывов возникают колбообразные выбухания, которые содержат большое число ядер и называются мышечными почками. При этом восстановления непрерывности волокон не происходит. Место разрыва заполняется грануляционной тканью, превращающейся в рубец (мышечная мозоль). Регенерация мышцы сердца при ее повреждении, как и при повреждении поперечнополосатой мускулатуры, заканчивается рубцеванием дефекта. Однако в сохранившихся мышечных волокнах происходит интенсивная гиперплазия ультраструктур, что ведет к гипертрофии волокон и восстановлению функции органа (см. рис. 81).
Регенерация эпителия осуществляется в большинстве случаев достаточно полно, так как он обладает высокой регенераторной способностью. Особенно хорошо регенерирует покровный эпителий. Восстановление многослойного плоского ороговевающего эпителия возможно даже при довольно крупных дефектах кожи. При регенерации эпидермиса в краях дефекта происходит усиленное размножение клеток зародышевого (камбиального), росткового (мальпигиева) слоя. Образующиеся эпителиальные клетки сначала покрывают дефект одним слоем. В дальнейшем пласт эпителия становится многослойным, клетки его дифференцируются, и он приобретает все признаки эпидермиса, включающего в себя ростковый, зернистый блестящий (на подошвах и ладонной поверхности кистей) и роговой слои. При нарушении регенерации эпителия кожи образуются незаживающие язвы, нередко с разрастанием в их краях атипичного эпителия, что может послужить основой для развития рака кожи.
Покровный эпителий слизистых оболочек (многослойный плоский неороговевающий, переходный, однослойный призматический и многоядерный мерцательный) регенерирует таким же образом, как и многослойный плоский ороговевающий. Дефект слизистой оболочки восстанавливается за счет пролиферации клеток, выстилающих крипты и выводные протоки желез. Недифференцированные уплощенные клетки эпителия сначала покрывают дефект тонким слоем (рис. 86), затем клетки принимают форму, свойственную клеточным структурам соответствующей эпителиальной выстилки. Параллельно частично или полностью восстанавливаются и железы слизистой оболочки (например, трубчатые железы кишки, железы эндометрия).
Регенерация мезотелия брюшины, плевры и околосердечной сумки осуществляется путем деления сохранившихся клеток. На поверхности дефекта появляются сравнительно крупные кубические клетки, которые затем уплощаются. При небольших дефектах мезотелиальная выстилка восстанавливается быстро и полно.
Важное значение для восстановления покровного эпителия и мезотелия имеет состояние подлежащей соединительной ткани, так как эпителизация любого дефекта возможна лишь после заполнения его грануляционной тканью.
Регенерация специализированного эпителия органов (печени, поджелудочной железы, почек, желез внутренней секреции, легочных альвеол) осуществляется по типу регенерационной гипертрофии: в участках повреждения ткань замещается рубцом, а по периферии его происходят гиперплазия и гипертрофия клеток паренхимы. В печени участок некроза всегда подвергается рубцеванию, однако в остальной части органа происходит интенсивное новообразование клеток, а также гиперплазия внутриклеточных стуктур, что сопровождается их гипертрофией. В результате этого исходная масса и функция органа быстро восстанавливаются. Регенераторные возможности печени почти безграничны. В поджелудочной железе регенераторные процессы хорошо выражены как в экзокринных отделах, так и в панкреатических островках, причем эпителий экзокринных желез становится источником восстановления островков. В почках при некрозе эпителия канальцев происходит размножение сохранившихся нефроцитов и восстановление канальцев, однако лишь при сохранении тубулярной базальной мембраны. При ее разрушении (тубулорексис) эпителий не восстанавливается и каналец замещается соединительной тканью. Не восстанавливается погибший канальцевый эпителий и в том случае, когда одновременно с канальцем погибает сосудистый клубочек. При этом на месте погибшего нефрона разрастается рубцовая соединительная ткань, а окружающие нефроны подвергаются регенерационной гипертрофии. В железах внутренней секреции восстановительные процессы также представлены неполной регенерацией. В легком после удаления отдельных долей в оставшейся части происходит гипертрофия и гиперплазия тканевых элементов. Регенерация специализированного эпителия органов может протекать атипично, что ведет к разрастанию соединительной ткани, структурной перестройке и деформации органов; в таких случаях говорят о циррозе (цирроз печени, нефроцирроз, пневмоцирроз).
Регенерация разных отделов нервной системы происходит неоднозначно. В головном и спинном мозге новообразования ганглиозных клеток не про-
 Рис. 86.
Регенерация эпителия в дне хронической язвы желудка
Рис. 86.
Регенерация эпителия в дне хронической язвы желудка
исходит и при разрушении их восстановление функции возможно лишь за счет внутриклеточной регенерации сохранившихся клеток. Невроглии, особенно микроглии, свойственна клеточная форма регенерации, поэтому дефекты ткани головного и спинного мозга обычно заполняются пролиферирующими клетками невроглии - возникают так называемые глиальные (глиозные) рубцы. При повреждении вегетативных узлов наряду с гиперплазией ультраструктур клеток происходит и их новообразование. При нарушении целости периферического нерва регенерация происходит за счет центрального отрезка, сохранившего связь с клеткой, в то время как периферический отрезок погибает. Размножающиеся клетки шванновской оболочки погибшего периферического отрезка нерва располагаются вдоль него и образуют футляр - так называемый бюнгнеровский тяж, в который врастают регенерирующие осевые цилиндры из проксимального отрезка. Регенерация нервных волокон завершается их миелинизацией и восстановлением нервных окончаний. Регенерационная гиперплазия рецепторов, перицеллюлярных синаптических приборов и эффекторов иногда сопровождается гипертрофией их концевых аппаратов. Если регенерация нерва в силу тех или иных причин нарушается (значительное расхождение частей нерва, развитие воспалительного процесса), то в месте его перерыва образуется рубец, в котором беспорядочно располагаются регенерировавшие осевые цилиндры проксимального отрезка нерва. Аналогичные разрастания возникают на концах перерезанных нервов в культе конечности после ее ампутации. Такие разрастания, образованные нервными волокнами и фиброзной тканью, называются ампутационными невромами.
Заживление ран
Заживление ран протекает по законам репаративной регенерации. Темпы заживления ран, его исходы зависят от степени и глубины раневого повреждения, структурных особенностей органа, общего состояния организма, применяемых методов лечения. По И.В. Давыдовскому, выделяют следующие виды заживления ран: 1) непосредственное закрытие дефекта эпителиального покрова; 2) заживление под струпом; 3) заживление раны первичным натяжением; 4) заживление раны вторичным натяжением, или заживление раны через нагноение.
Непосредственное закрытие дефекта эпителиального покрова - это простейшее заживление, заключающееся в наползании эпителия нд поверхностный дефект и закрытии его эпителиальным слоем. Наблюдаемое на роговице, слизистых оболочках заживление под струпом касается мелких дефектов, на поверхности которых быстро возникает подсыхающая корочка (струп) из свернувшейся крови и лимфы; эпидермис восстанавливается под корочкой, которая отпадает через 3-5 сут после ранения.
Заживление первичным натяжением (per rimamm intentionem) наблюдается в ранах с повреждением не только кожи, но и подлежащей ткани,
причем края раны ровные. Рана заполняется свертками излившейся крови, что предохраняет края раны от дегидратации и инфекции. Под влиянием протеолитических ферментов неитрофилов происходит частичный лизис свертка крови, тканевого детрита. Нейтрофилы погибают, на смену им приходят макрофаги, которые фагоцитируют эритроциты, остатки поврежденной ткани; в краях раны обнаруживается гемосидерин. Часть содержимого раны удаляется в первый день ранения вместе с экссудатом самостоятельно или при обработке раны - первичное очищение. На 2-3-и сутки в краях раны появляются растущие навстречу друг другу фибробласты и новообразованные капилляры, появляется грануляционная ткань, пласт которой при первичном натяжении не достигает больших размеров. К 10-15-м суткам она полностью созревает, раневой дефект эпителизируется и рана заживает нежным рубчиком. В хирургической ране заживление первичным натяжением ускоряется в связи с тем, что ее края стягиваются нитями шелка или кетгута, вокруг которых скапливаются рассасывающие их гигантские клетки инородных тел, не мешающие заживлению.
Заживление вторичным натяжением (per secundam intentionem), или заживление через нагноение (или заживление посредством гранулирования - per granulationem), наблюдается обычно при обширных ранениях, сопровождающихся размозжением и омертвением тканей, проникновении в рану инородных тел, микробов. На месте раны возникают кровоизлияния, травматический отек краев раны, быстро появляются признаки демаркационного гнойного воспаления на границе с омертвевшей тканью, расплавление некротических масс. В течение первых 5-6 сут происходит отторжение некротических масс - вторичное очищение раны, и в краях раны начинает развиваться грануляционная ткань. Грануляционная ткань, выполняющая рану, состоит из 6 переходящих друг в друга слоев (Аничков Н.Н., 1951): поверхностный лейкоцитарно-некротический слой; поверхностный слой сосудистых петель, слой вертикальных сосудов, созревающий слой, слой горизонально расположенных фибробластов, фиброзный слой. Созревание грануляционной ткани при заживлении раны вторичным натяжением сопровождается регенерацией эпителия. Однако при этом виде заживления раны на месте ее всегда образуется рубец.
Регенерация (от лат. regeneratio - возрождение) представляет собой процесс обновления всех функционирующих структур организма (биомолекул, клеточных органелл, клеток, тканей, органов и всего организма) и является проявлением важнейшего атрибута жизни - самообновления. Так, физиологическая регенерация на клеточном и тканевом уровне - это обновление эпидермиса, волос, ногтей, роговицы, эпителия слизистой кишечника, клеток периферической крови и др. Согласно изотопному методу, состав атомов человеческого тела в течение года обновляется на 98%. При этом клетки слизистой желудка обновляются за 5 дней, жировые клетки - за 3 недели, клетки кожи - за 5 недель, клетки скелета - за 3 месяца.
Регенерация в широком смысле слова - это и нормальное обновление органов и тканей, и восстановление утраченного, и ликвидация повреждений, и, наконец, реконструкция (воссоздание органа).
Организм располагает двумя главными стратегиями замены ткани и самообновления (регенерации). Первый путь состоит в том, что дифференцированные клетки замещаются в результате их образования новых из регионарных стволовых клеток. Примером этой категории являются стволовые кроветворные клетки. Второй путь состоит в том, что регенерация ткани происходит за счет дифференцированных клеток, но сохранивших способность к делению: например, гепатоциты, скелетно-мышечные и эндотелиальные клетки.
Фазы регенерации : пролиферация (митоз, увеличение количества недифференцированных клеток), дифференцировка (структурно-функциональная специализация клеток) и формообразование.
Виды и формы регенерации
1. Клеточная регенерация - это обновление клеток в результате митоза недифференцированных или слабо дифференцированных клеток.
Для нормального протекания процессов регенерации определяющую роль играют не только стволовые клетки, но и другие клеточные источники, специфическую активацию которых осуществляют биологически активные вещества (гормоны, простагландины, поэтины, специфические факторы роста):
- активация резервных клеток, остановившихся на раннем этапе своей дифференцировки и не участвующих в процессе развития до получения стимула к регенерации
Временная дедифференцировка клеток в ответ на регенеративный стимул, когда дифференцированные клетки утрачивают признаки специализации, а затем снова дифференцируются в тот же клеточный тип
Метаплазия - превращение в клетки другого типа: например, хондроцит трансформируется в миоцит или наоборот (органопрепарат как адекватный детерминантный стимул физиологической метаплазии клеток).
2. Внутриклеточная регенерация - обновление мембран, сохранившихся органелл либо увеличение их числа (гиперплазия) и размеров (гипертрофия).
3. Биохимическая регенерация - обновление биомолекулярного состава клетки, её органоидов, ядра, цитоплазмы (например, пептидов, факторов роста, коллагена, гормонов и т.д.). Внутриклеточная форма регенерации является универсальной, так как она свойственна всем органам и тканям.
Репаративная регенерация (от лат. reparatio - восстановление) наступает после повреждения ткани или органа (например, механическая травма, оперативное вмешательство, действие ядов, ожоги, обморожения, лучевые воздействия и др.). В основе репаративной регенерации лежат те же механизмы, которые свойственны физиологической регенерации.
Очень высоки способности к репарации внутренних органов: печени, яичника, слизистой кишечника и др. В качестве примера можно привести печень, в которой источник регенерации практически неиссякаем, доказательством чего являются широко известные экспериментальные данные, полученные на животных: при 12-кратном удалении трети печени в течение года у крыс к концу года под влиянием органопрепаратов печень восстанавливала свои нормальные размеры.
Репаративная регенерация таких тканей, как мышечная и скелетная, имеет определённые особенности. Для репарации мышцы важно сохранение небольших её культей на обоих концах, а для регенерации кости необходима надкостница. Индукторами репарации являются биологически активные вещества, выделяющиеся при повреждении ткани. Кроме того, индукторами могут быть отдельные фрагменты этой же повреждённой ткани: полное замещение дефекта костей черепа удаётся получить после введения в него костных опилок.
Репаративная регенерация может происходить в двух формах.
1. Полной регенерации - участок некроза заполняется тканью, идентичной погибшей, и место повреждения исчезает полностью. Такая форма характерна для тканей, в которых регенерация протекает преимущественно в клеточной форме. К полной регенерации можно отнести восстановление внутриклеточных структур при дистрофии клеток (например, жировая дистрофия гепатоцитов у людей злоупотребляющих алкоголь).
2. Неполной регенерации – участок некрозазамещается соединительной тканью, а нормализация функции органа происходит за счет гиперплазии сохранившихся окружающих клеток (инфаркт миокарда). Такой способ имеет место в органах с преимущественно внутриклеточной регенерацией.
Перспективы научных исследований по регенерации. В настоящее время активно исследуются органопрепараты – экстракты содержимого живой клетки со всеми входящими в нее важными клеточными макромолекулами (белки, биорегуляторные вещества, факторы роста и дифференцировки). Каждая ткань имеет определенную биохимическую специфику клеточного содержимого. Благодаря этому, изготавливается большое количество органопрепаратов с адресной направленностью на определенные ткани и органы.
В целом прямое влияние органопрепаратов, как эталонов биохимизма клеток, состоит в первую очередь в ликвидации клеточного дисбаланса биорегуляторов процессов регенерации, на поддержание баланса оптимальных концентраций биомолекул и на сохранение химического гомеостаза, который нарушен в условиях не только любой патологии, но и при функциональных изменениях. Это приводит к восстановлению митотической активности, дифференцировки клеток и регенераторного потенциала ткани. Органопрепараты обеспечивают качество важнейшей характеристики процесса физиологической регенерации - способствуют появлению в процессе деления и дифференцировки здоровых и функционально активных клеток, устойчивых к токсинам среды, метаболитам и другим воздействиям. Такие клетки формируют специфическое микроокружение, характерное для данного вида здоровой ткани, которая оказывает угнетающее воздействие на существующие "плюс-ткани" и предотвращает появление малигнизированных клеток.
Итак, влияние органопрепаратов на процессы физиологической регенерации состоит в том, что они, с одной стороны, незрелые развивающиеся клетки гомологичной ткани (региональные стволовые клетки и др.) стимулируют к нормальному развитию в зрелые формы, т.е. стимулируют митотическую активность нормальных тканей и дифференцировку клеток, а с другой стороны, нормализуют клеточный метаболизм в гомологичных тканях. В результате в гомологичной ткани осуществляется физиологическая регенерация с образованием нормальных клеточных популяций с оптимальным метаболизмом и весь этот процесс носит физиологический характер. Благодаря этому, при повреждении органа (например, кожи или слизистой желудка) органопрепараты обеспечивают идеальную репарацию - заживление без рубца.
Необходимо подчеркнуть, что восстановление митотической активности и дифференцировки клеток под влиянием органопрепаратов является ключевым в исправлении дефектов и аномалий развития органов у детей.
В условиях патологии или ускоренного старения процессы физиологической регенерации также имеют место, но они не имеют такого качества - появляются молодые клетки, которые не устойчивы к циркулирующим токсинам, недостаточно выполняют свои функции, не способны противостоять патогенам, что создаёт условия для сохранения патологического процесса в ткани или органе, для развития преждевременного старения. Отсюда понятна и очевидна целесообразность применения органопрепаратов как средств, способных наиболее эффективно восстановить регенераторный потенциал и биохимический гомеостаз ткани, органа и всего организма и таким образом воспрепятствовать процессам старения. А это ни что иное, как ревитализация.
Что такое Регенерация клеток
Регенерация клеток – это акт обновления, роста или восстановления клеток, участвующих в заживлении ран, восстановлении тканей и подобных биологических функциях. Данная биологическая особенность присуща всем живым организмам, от бактерий до растений и от земноводных до млекопитающих.
У людей, к сожалению, клеточная регенерация имеет ограниченные возможности по сравнению с некоторыми представителями жизни на нашей планете. К примеру, представителями экстремальной регенерации могут выступить:
- Морские звезды и ящерицы способны вырастить сломанные или оторванные конечности.
- Плоские черви могут полностью клонировать всю структуру своего тела с целью размножения.
Регенерация клеток как процесс размножения.
Хотя все организмы, включая бактерии, грибы и дрожжи, обладают биологической способностью к регенерации клеток, этот процесс по-разному проявляется в каждом отдельном организме. Поддержание биологической целостности организма является основной целью клеточной регенерации. Некоторые организмы также используют регенерацию клеток как форму бесполого размножения. Например, дрожжи размножаются посредством бесполого процесса регенерации клеток, известного как почкование. Новая ячейка растет как отдельный кусок, прикрепленный к старой ячейке. Она собирает информацию о ДНК для воспроизведения точной копии клетки. После достижения зрелости, новая клетка отделяется и становится независимой от клетки-хозяина, что позволяет дрожжам и подобным грибам размножаться и расти.
Комплексная регенерация.
Некоторые рептилии и амфибии обладают способностью к комплексной клеточной регенерации. Данная особенность позволяет тканевым структурам восстанавливаться после повреждения посредством процесса, известного как автотомия.
Когда происходит травма или такие существа находятся в опасности, взрослые клетки в хвостах, плавниках и других придатках могут отделиться от основного тела, оставив придаток позади. Как часть естественного биохимического процесса, клетки на краях таких повреждений морфируются обратно в стволовые клетки. Это позволяет процессу регенерации клеток, отрастить новый придаток взамен утраченного.
Регенерация клеток у человека.
У человека регенерация клеток представляет собой несколько иной процесс. Стволовые клетки, как строительные блоки, позволяют эмбриону образовывать органы, ткани и придатки, только в процессе формирования. Как только клетки развиваются, они не могут снова вернуться к стволовым клеткам, как это наблюдается у некоторых рептилий и амфибий.
Ежедневно в человеческом теле умирают миллиарды клеток вследствие некроза или апоптоза.
Апоптоз — это форма запрограммированной клеточной смерти, которая позволяет клеткам фрагментироваться или иначе умирать как часть нормального биохимического процесса, связанного с развитием, ростом и старением. Без какой-либо формы регенерации клеток, некроз и апоптоз, в конечном итоге приведут к разрушению целых органов и тканей. Но благодаря клеточной регенерации, наше тело выращивает новые клетки, чтобы заменить мертвые.

Сейчас много говорят о выращивании отдельных органов вне организма и приращении их взамен утраченных. Но, может быть, есть способ лучше — просто восстанавливать или, выражаясь по-научному, регенерировать свои органы?
В принципе, человек отчасти наделен этим даром. Наши порезы зарастают благодаря регенерации кожи. Кровь тоже регенерируется. Но хочется большего. Причем мечтают об этом не только простые обыватели, но и ученые.
Скажем, сотрудники Лаборатории проблем регенерации Института биологии развития РАН, которой руководит доктор биологических наук Виктор Миташов, давно разрабатывает различные методы восстановления кости и нервных тканей человека, а в последнее время и сетчатки глаза. Вообще-то низшие организмы чаще способны к регенерации, чем более высокоорганизованные.
Так, среди беспозвоночных гораздо больше видов, способных восстанавливать утраченные органы, чем среди позвоночных, но лишь у некоторых из них возможна регенерация целой особи из небольшого ее фрагмента. Такие примитивные животные, как гребневики и коловратки, практически не способны к регенерации, а у гораздо более сложных ракообразных и амфибий эта способность хорошо выражена.
Многие бы хотели получит себе регенерацию как у Росомахи, героя американских комиксов. Он может за считанные минуты залечить даже самые страшные раны
Особенно удивительна способность к регенерации у губок. Ученые поставили необычный эксперимент; продавили тело взрослой губки через сетчатую ткань и отделили все образовавшиеся фрагментики друг от друга. Оказалось, что если затем поместить эти маленькие кусочки в воду и хорошенько перемешать, полностью разрушив все связи между ними, то некоторое время спустя они начнут постепенно сближаться и в конце концов воссоединятся, образовав целую губку, сходную с прежней. В этом участвует своего рода «узнавание» на клеточном уровне.
Еще один рекордсмен регенерации — ленточный червь, который способен воссоздать целую особь из любого участка своего тела. Теоретически возможно, разрезав одного червя на 200 000 кусочков, получить из него в результате регенерации столько же новых червей. А из одного луча морской звезды может возродиться целая звезда.
Но куда более известен другой пример — ящерицы, которые отращивают себе хвост, и тритоны, которые могут регенерировать глаза, лапы и хвост до шести раз.


Увы, человек этого бесценного свойства лишен. А не может ли современная наука помочь нам овладеть соответствующими механизмами?
При пересчете на жизнь человека процесс восстановления подобный тритоновскому мог бы занять у нас всего полгода. Однако разобраться до конца, каким образом тритон за месяц восстанавливает глаз, очень непросто. Ученые повторить его подвиги пока не могут. Но уже стало ясно, как он и ему подобные, это делают.
Начнем с самого начала — с рождения организма. Известно, что в ходе зародышевого развития клетки любого многоклеточного организма проходят специализацию. Из одних получаются, например, ноги, из других, скажем, мускулы, жабры или глаза. Так называемые Дох-гены дают команду как всему организму, так и конкретным органам развиваться по определенному плану — чтобы не получилось, что глаз вырастет там, где должна быть нога.
У мушки дрозофилы 8 Дох-генов, у лягушки — 6, а у человека — 38. И выяснилось, что при регенерации тритон «вспоминает» свое эмбриональное прошлое, включая генетическую программу, которая активирует Дох-гены и восстанавливает удаленные или поврежденные ткани и органы.
Но глаз или хвост должен из чего-то возникнуть — не может же он регенерироваться из воздуха. У организма есть два пути — нарабатывать новые клетки, новый строительный материал либо пользоваться тем, что осталось после утраты органа.
Выяснилось, что природа использует оба этих способа. «Кирпичами» для регенерации служат эмбриональные стволовые клетки. Так называют клетки эмбриона, которые в своем развитии просто не доросли до стадии специализации и, следовательно, способны под воздействием тех или иных факторов превратиться в клетки различных тканей и органов более чем двух сотен типов.
Причем при регенерации «старые» клетки тритона путем сложных манипуляций превращаются в сходные с эмбриональными. С ними в последнее время связано много споров. Дело в том, что для ученых главный источник эмбриональных стволовых клеток — человеческие эмбрионы. Биологи с большим энтузиазмом изучают свойства эмбриональных стволовых клеток: ведь в случае успеха эти клетки откроют совершенно новые возможности в хирургии и обеспечат восстановление тех или иных органов. Если в результате заболевания выйдут из строя какие-то группы клеток, пусть даже узкоспециализированных, то будет возможность их заменить.

И наши биологи в этих работах вовсе не на последних ролях. Скажем, академик Российской академии естественных наук Леонид Полежаев на протяжении десятилетий занимался проблемой регенерации костей свода черепа. Сначала ему удалось добиться регенерации костей черепа у собак и крыс. Затем совместно с медиками из Института нейрохирургии имени Н.Н. Бурденко АМН СССР попытались восстанавливать кости черепа у больных с травмами головы.
При этом использовались костные опилки, которые «побуждали» кости человеческого черепа к регенерации. В результате область травмы полностью закрывалась новой костью. При помощи этой методики было проведено более 250 операций.
Недавно группа ученых из Токийского университета под руководством Макото Асашимы культивировала в специальном растворе витамина А тысячи эмбриональных стволовых клеток, варьируя концентрацию витамина. Низкая концентрация активирует гены, которые контролируют развитие глазной ткани, тогда как высокая концентрация запускает работу генов, ответственных за формирование органа слуха.
Макото Асашима заявил, что таким образом целый лягушачий глаз можно получить за пять дней. Подобным, но более простым методом прежде были выращены и успешно пересажены лягушке новые почки. Животное-реципиент после этой операции прожило месяц.
А специалисты из токийского Университета Кэйо опубликовали отчет об успешном эксперименте по использованию стволовых клеток человеческого эмбриона для восстановления поврежденных тканей спинного мозга у обезьян. Как сообщил руководитель работ профессор Хидэюки Окано, исходные стволовые клетки были взяты у погибшего человеческого эмбриона с согласия родителей и одобрения университетского совета по этике.
Затем эти клетки размножили в питательной среде и подсадили пятерым обезьянам (по 10 млн клеток каждой), у которых передние конечности были обездвижены в результате травмы позвоночника. У одного примата все опорно-двигательные функции вошли в норму уже через два месяца, а у остальных процесс восстановления продолжается.
В лаборатории Виктора Миташова успешно проведены опыты по восстановлению глаза тритона. А ныне исследователи готовятся к экспериментам по выращиванию сетчатки глаза человека.
Но вот о возможности выращивания целого глаза специалисты говорят осторожно. Их можно понять: слишком велика эволюционная пропасть между тритоном и человеком. Нос другой стороны, механизмы развития органов похожи, поэтому есть надежда, что когда-нибудь биологам удастся заставить травмированного человека, «впадая в детство», выращивать нужные органы — зубы, взамен выпавших, новые клетки печени, почек, поджелудочной железы, новые мышечные ткани для сердца, пораженного инфарктом миокарда.
